Amine – một dẫn xuất của amoniac, đóng vai trò quan trọng trong nhiều lĩnh vực của hóa học hữu cơ. Từ cấu tạo phân tử đặc trưng đến tính chất hóa học đa dạng, amine đã trở thành chủ đề nghiên cứu hấp dẫn của nhiều nhà khoa học. Bài viết này sẽ giúp bạn nắm vững lý thuyết về amine theo chương trình hóa học 12, từ đó mở rộng kiến thức về thế giới phân tử kỳ diệu.
Khái niệm, phân loại, đồng phân và danh pháp Amine

Amine là gì?
Amine là hợp chất được hình thành từ ammonia, trong đó một hoặc nhiều nguyên tử hydro trong ammonia đã được thay thế bằng nhóm hydrocarbon.
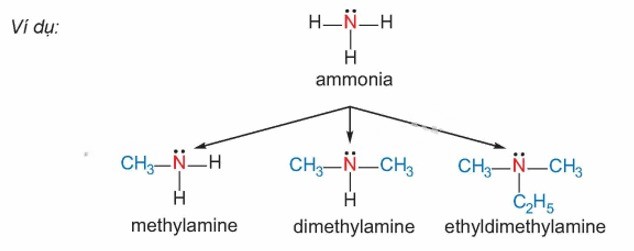
Phân loại Amine
Amine thường được xếp loại dựa vào bậc của amine và loại gốc hydrocarbon liên kết với nó.
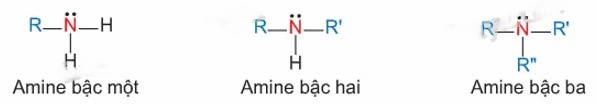
Bậc của amine được xác định dựa trên số lượng gốc hydrocarbon gắn trực tiếp với nguyên tử nitơ.
Căn cứ vào điều này, amine được chia thành ba loại: amine bậc một, amine bậc hai, và amine bậc ba.
Dựa vào cấu trúc của nhóm hydrocarbon, amine được phân loại thành nhiều dạng khác nhau.
Trong số đó, hai loại phổ biến bao gồm alkylamine (nhóm amine gắn với gốc alkyl) và arylamine (nhóm amine kết nối trực tiếp với nguyên tử carbon trong vòng benzene).
Đồng phân
Các amine khi có ít nhất hai nguyên tử carbon trong phân tử thì bắt đầu có sự xuất hiện của các đồng phân. Các đồng phân của amine có thể khác nhau về bậc của amine, cấu trúc mạch carbon, và vị trí của nhóm amine trong phân tử.
Danh pháp
Các amine khi có ít nhất hai nguyên tử carbon trong phân tử thì bắt đầu có sự xuất hiện của các đồng phân.
Các đồng phân của amine có thể khác nhau về bậc của amine, cấu trúc mạch carbon, và vị trí của nhóm amine trong phân tử.
Đặc điểm cấu tạo Amine
Hình dạng phân tử của methylamine và anilin được miêu tả như sau:
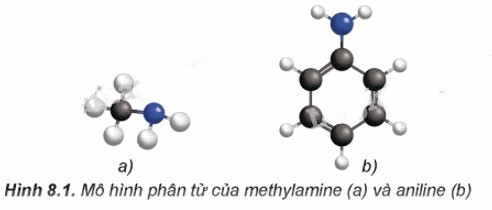
Trong phân tử của amine, nguyên tử nitơ vẫn giữ một cặp electron tự do. Do cấu tạo của amine giống với ammonia, nên amine cũng sở hữu một số đặc tính hóa học tương tự như ammonia.
Tính chất vật lí Amine
- Amine có điểm sôi cao hơn so với chất hydrocarbon có cùng số lượng nguyên tử carbon hoặc có khối lượng phân tử tương đương.
- Methylamine, ethylamine, dimethylamine và trimethylamine là những chất khí với mùi tanh giống như mùi cá hoặc mùi khai tương tự như ammonia, phụ thuộc vào nồng độ. Các amine với số lượng nguyên tử carbon ít thường hòa tan tốt trong môi trường nước nhờ khả năng tạo liên kết hydrogen với nước.
Tính chất hóa học Amine
Tính base và phản ứng tạo phức
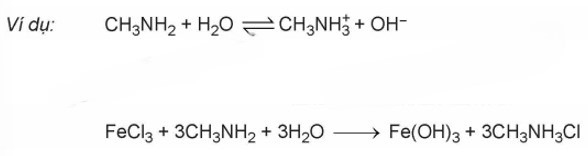
Amine biểu hiện tính bazơ yếu. Dung dịch của các alkylamine có thể làm quỳ tím chuyển sang màu xanh, trong khi dung dịch anilin thì không làm quỳ tím thay đổi màu.
Các amine như methylamine và ethylamine khi phản ứng với Cu(OH)2 sẽ tạo thành dung dịch phức chất màu xanh lam.
Phản ứng với Nitrous acid
- Alkylamine bậc một khi tác dụng với axit nitơơ (nitrous acid) ở nhiệt độ phòng sẽ tạo ra ancol và giải phóng khí nitơ (phản ứng này thường được sử dụng để phân biệt alkylamine bậc một).
Ví dụ: CH3NH2 + HONO → CH3OH + N2 + H2O
- Anilin khi phản ứng với axit nitơơ ở nhiệt độ thấp sẽ tạo thành muối diazonium.
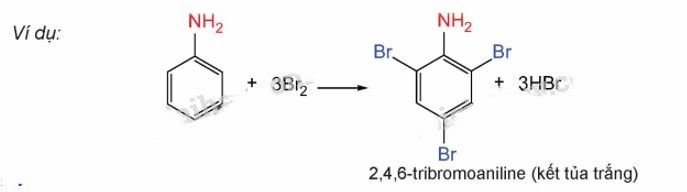
Phản ứng của Anilin với nước Bromine
Do ảnh hưởng của nhóm – NH2, anilin có khả năng tham gia vào phản ứng thế nguyên tử hydro của vòng benzene mạnh hơn so với benzene, thường ưu tiên thế vào vị trí ortho và para liền kề với nhóm – NH2.
Ứng dụng của Amine
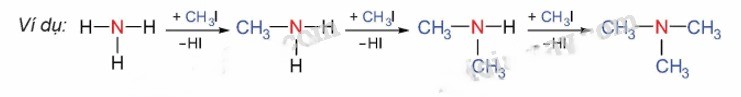
Alkyl hóa ammonia
Alkylamine được sản xuất bằng cách phản ứng giữa ammonia và các dẫn xuất halogen.
Khử hợp chất nitro
Anilin và các arylamine thường được tổng hợp thông qua phản ứng khử nitrobenzene bằng một số kim loại như Zn, Fe,… trong môi trường dung dịch HCl.
![]()
Trên đây là tổng hợp lý thuyết về Anime là gì cũng như những tính chất và ứng dụng ngoài thực tiễn. Bên cạnh đó, đừng bỏ qua những bài viết khác:
>> Xem thêm >>











 Giới thiệu
Giới thiệu Chính sách bảo mật
Chính sách bảo mật Câu hỏi thường gặp
Câu hỏi thường gặp Liên hệ
Liên hệ Kiến thức lớp 10
Kiến thức lớp 10 Cẩm nang học tập
Cẩm nang học tập Định nghĩa
Định nghĩa