Liên kết ion là gì? Bài viết sau đây sẽ giải đáp đầy đủ, ngắn gọn giúp các em học sinh có thể nắm bắt được tốt kiến thức về hoá học và cũng sẽ có những ví dụ để các em hiểu rõ hơn về loại liên kết hoá học này.
Tìm hiểu về sự tạo thành ion
– Nguyên tử nhường electron tạo thành cation hoặc nhận electron tạo thành anion.
+ Khi cho electron, nguyên tử sẽ trở thành ion dương (cation)
Ví dụ:
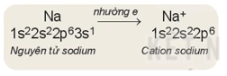
Rút gọn: Na→Na++1e−
– Khi nhận electron, nguyên tử sẽ trở thành ion âm (anion)
Ví dụ:
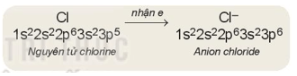
Rút gọn: Cl+1e−→Cl−
Chú ý:
– Số đơn vị điện tích của ion dương (cation) tương ứng với số electron mà nguyên tử đã nhường đi.
– Số đơn vị điện tích của ion âm (anion) tương ứng với số electron mà nguyên tử đã nhận vào.
– Các ion thường có cấu hình electron bền vững, giống với nguyên tử khí hiếm gần nhất trong bảng tuần hoàn so với nguyên tố tạo thành ion đó.
+ Ngoài các ion được tạo thành từ 1 nguyên tử (ion đơn nguyên tử) như Na+; Cl− … còn có các ion tạo thành từ hai hay nhiều nguyên tử (ion đa nguyên tử), ví dụ: NH+4; OH−; NO−3…
<<Xem thêm>> Lý thuyết hoá 10 bài 10 Kết nối tri thức: Quy tắc octet
Giải thích sự tạo thành liên kết ion lớp 10 kết nối tri thức
– Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
– Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
– Các hợp chất tạo nên từ các ion được gọi là hợp chất ion.
– Ví dụ: Sự hình thành liên kết ion trong phân từ sodium chloride:
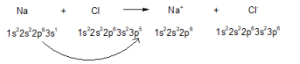
hoặc
![]()
Tinh thể ion trong hóa học
Cấu trúc của tinh thể ion là gì?
– Cấu trúc của tinh thể ion là các ion được sắp xếp theo một trật tự cụ thể trong không gian, tạo thành một mạng lưới, trong đó các nút mạng là các ion dương và ion âm, xếp xen kẽ và liên kết chặt chẽ nhờ sự cân bằng giữa lực hút và lực đẩy.
– Trong tinh thể ion, số ion cùng dấu bao quanh một ion trái dấu phụ thuộc vào kiểu mạng lưới tinh thể, số điện tích và kích thước của ion.
Độ bền và tính chất của các hợp chất ion
– Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
– Do lực hút tĩnh điện rất mạnh giữa các ion nên các tinh thể ion khá rắn, chắc nhưng khá giòn. Đây là tính chất đặc trưng của tinh thể ion.
– Các hợp chất ion thường tan nhiều trong nước.
– Ở trạng thái rắn các hợp chất ion không dẫn điện, tuy nhiên ở trạng thái nóng chảy hoặc khi tan trong nước thì dẫn điện.
Tóm lại, liên kết ion là một phần quan trọng trong hóa học lớp 10, giúp chúng ta hiểu cách các ion tương tác để tạo thành hợp chất. Nắm vững lý thuyết và cấu trúc mạng tinh thể ion. Hy vọng Kiến thức THPT đã cung cấp được những kiến thức hữu ích cho quá trình học tập của bạn.











 Giới thiệu
Giới thiệu Chính sách bảo mật
Chính sách bảo mật Câu hỏi thường gặp
Câu hỏi thường gặp Liên hệ
Liên hệ Kiến thức lớp 10
Kiến thức lớp 10 Cẩm nang học tập
Cẩm nang học tập Định nghĩa
Định nghĩa