Cân bằng hóa học là một khái niệm nền tảng trong chương trình Hóa học lớp 11. Vậy cân bằng hóa học là gì? Và những yếu tố nào có thể ảnh hưởng đến trạng thái cân bằng này? Cùng Kiến thức THPT tìm hiểu chi tiết trong nội dung dưới đây.
Lý thuyết về cân bằng hóa học lớp 11 mới nhất

Lý thuyết về cân bằng hóa học lớp 11
Phản ứng một chiều và phản ứng thuận nghịch như thế nào
Phản ứng không thuận nghịch
- Phản ứng không thuận nghịch diễn ra theo một hướng nhất định trong cùng một điều kiện. Biểu thức hóa học của phản ứng này được thể hiện qua một mũi tên chỉ hướng diễn ra của phản ứng.
Ví dụ: NaOH + HCl → NaCl + H2O
Phản ứng có thuận nghịch
- Phản ứng có thuận nghịch là loại phản ứng diễn ra theo hai hướng đối lập nhau trong cùng một điều kiện.
- Công thức hóa học cho phản ứng có thuận nghịch được biểu diễn bởi hai mũi tên đối nhau. Mũi tên từ trái sang phải chỉ phản ứng thuận và mũi tên từ phải sang trái chỉ phản ứng nghịch.
- Thực tế cho thấy phản ứng thuận nghịch không xảy ra hoàn toàn do các chất tham gia phản ứng tạo thành sản phẩm (phản ứng thuận), và ngược lại, các sản phẩm lại phản ứng với nhau tạo thành các chất ban đầu (phản ứng nghịch).
Ví dụ: Cl2 + H2O ⇌ HCl + HClO
>> Xem thêm: Nitrogen hóa trị mấy – Hóa Học 11
Cân bằng hóa học
Trạng thái cân bằng
Trạng thái cân bằng trong phản ứng thuận nghịch đạt được khi tốc độ của phản ứng thuận và phản ứng nghịch bằng nhau.
Cân bằng hóa học là cân bằng động, nơi các chất phản ứng không ngừng chuyển hóa thành sản phẩm và ngược lại, sản phẩm tiếp tục chuyển hóa thành các chất phản ứng với tốc độ đồng đều, do đó dù có sự chuyển hóa liên tục nhưng nồng độ các chất vẫn không thay đổi khi đã đạt trạng thái cân bằng.
Hằng số cân bằng
- Công thức tính hằng số cân bằng
Đối với phản ứng thuận nghịch chung aA + bB ⇌ cC + dD:
Khi phản ứng đạt trạng thái cân bằng, hằng số cân bằng (Kc) của phản ứng được tính theo công thức:
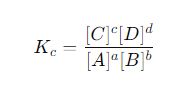
Ở đây: [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, và D khi đạt trạng thái cân bằng. Các hệ số a, b, c, d trong phương trình hóa học chỉ số mol tương ứng của mỗi chất tham gia phản ứng.
Nghiên cứu cho thấy hằng số cân bằng Kc của phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và tính chất của phản ứng. Đối với phản ứng có chất rắn, không tính nồng độ của chất rắn trong công thức tính hằng số cân bằng.
- Ý nghĩa của hằng số cân bằng
Hằng số cân bằng Kc thể hiện mức độ phụ thuộc vào nhiệt độ và tính chất của phản ứng. Biểu thức của Kc cho thấy nếu Kc lớn, phản ứng thuận sẽ chiếm ưu thế; ngược lại, nếu Kc nhỏ, phản ứng nghịch sẽ chiếm ưu thế hơn.
Các yếu tố ảnh hưởng đến cân bằng hóa học

Các yếu tố ảnh hưởng đến cân bằng hóa học
- Tác động của nhiệt độ
Khi nhiệt độ tăng lên, cân bằng sẽ dịch chuyển theo hướng giảm bớt nhiệt độ, tức là theo hướng phản ứng thu nhiệt (ΔrH, 298K > 0), nhằm giảm ảnh hưởng của việc tăng nhiệt và ngược lại.
- Ảnh hưởng của nồng độ
Khi tăng nồng độ của một chất trong phản ứng, cân bằng hóa học bị xáo trộn và sẽ dịch chuyển theo hướng làm giảm nồng độ chất đó để khôi phục lại trạng thái cân bằng, và ngược lại khi giảm nồng độ.
- Nguyên tắc chuyển dịch cân bằng Le Chatelier
Khi một phản ứng thuận nghịch đang ở trạng thái cân bằng mà bị tác động bởi sự một sự thay đổi của các yếu tố như nồng độ, nhiệt độ, hoặc áp suất từ bên ngoài, cân bằng sẽ dịch chuyển theo hướng làm giảm ảnh hưởng của sự thay đổi đó.
Nguyên tắc Le Chatelier có tầm quan trọng rất lớn trong ứng dụng công nghiệp hóa học. Bằng cách điều chỉnh các điều kiện phản ứng, người ta có thể chuyển dịch cân bằng theo hướng mong muốn để nâng cao hiệu suất của phản ứng.
Phần kết
Qua bài viết này, chúng ta đã cùng nhau tìm hiểu về khái niệm cân bằng hóa học và các yếu tố ảnh hưởng đến nó. Hy vọng nội dung này hữu ích cho bạn đọc trong quá trình trau dồi kiến thức của mình.










 Giới thiệu
Giới thiệu Chính sách bảo mật
Chính sách bảo mật Câu hỏi thường gặp
Câu hỏi thường gặp Liên hệ
Liên hệ Kiến thức lớp 10
Kiến thức lớp 10 Cẩm nang học tập
Cẩm nang học tập Định nghĩa
Định nghĩa