Bảng tuần hoàn là một bảng phân loại các nguyên tố hóa học dựa trên các đặc tính và cấu trúc của chúng. Sau đây chúng ta sẽ cùng tìm hiểu sâu hơn về cách sắp xếp và cấu tạo bảng tuần hoàn các nguyên tố hóa học.
Lịch sử phát minh bảng tuần hoàn các nguyên tố hóa học
Khi đã có kiến thức đáng kể về các nguyên tố hóa học, con người đã bắt đầu tìm cách phân loại chúng:
– Cách phân loại đầu tiên được A. Lavoisier thực hiện vào năm 1789, trong đó ông sắp xếp 33 nguyên tố hóa học thành các nhóm: chất khí, kim loại, phi kim và đất.
– Đến năm 1829, J. W. Dobereiner đã phân loại các nguyên tố thành các nhóm có tính chất hóa học tương tự. Ví dụ, lithium, sodium và potassium được xếp vào nhóm kim loại mềm, dễ phản ứng.
– Năm 1866, J. Newlands đã tổ chức các nguyên tố theo thứ tự tăng dần của khối lượng nguyên tử thành các quãng tám, trong đó nguyên tố thứ tám lặp lại tính chất của nguyên tố đầu tiên.
– Năm 1869, hai nhà hóa học D. I. Mendeleev và J. L. Meyer đã sắp xếp các nguyên tố theo thứ tự tăng khối lượng nguyên tử vào các hàng và cột. Họ bắt đầu mỗi hàng (bảng của Mendeleev) hoặc cột mới (bảng của Meyer) khi các tính chất của nguyên tố lặp lại. Trong bảng của mình, Mendeleev đã điều chỉnh vị trí của một số nguyên tố để phù hợp với quy luật và để lại một số chỗ trống cho các nguyên tố chưa được phát hiện.
– Sau này, các nguyên tố hóa học ở những vị trí còn trống đó đã được tìm thấy, và tính chất của chúng hoàn toàn phù hợp với những dự đoán của Mendeleev.
– Hiện nay, với những hiểu biết về cấu tạo nguyên tử, bảng tuần hoàn các nguyên tố hóa học hiện đại sắp xếp 118 nguyên tố theo chiều tăng điện tích hạt nhân nguyên tử.
Nguyên tắc sắp xếp bảng tuần hoàn hoá học lớp 10
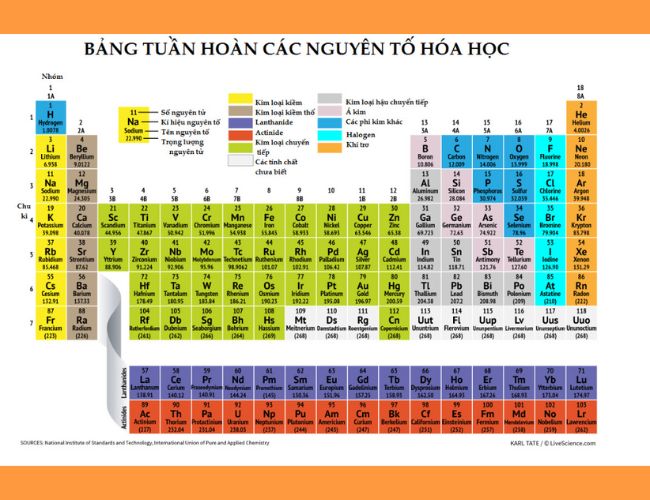
Bảng tuần hoàn các nguyên tố hóa học
Bảng tuần hoàn bao gồm 118 nguyên tố hóa học được sắp xếp theo các nguyên tắc sau:
– Các nguyên tố được xếp theo thứ tự tăng dần của điện tích hạt nhân nguyên tử.
– Những nguyên tố có cùng số lớp electron trong nguyên tử sẽ nằm trên cùng một hàng.
– Các nguyên tố có số electron hóa trị giống nhau được xếp vào cùng một cột.
Với cách sắp xếp này, sự tuần hoàn của các tính chất của các đơn chất và hợp chất được thể hiện qua chu kỳ (hàng) và nhóm (cột).
Cấu tạo bảng tuần hoàn các nguyên tố hóa học lớp 10
Ô nguyên tố
– Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn các nguyên tố hóa học, gọi là ô nguyên tố.
– Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hóa học trong ô đó.
– Mỗi ô nguyên tố có các thông tin quan trọng về nguyên tố hóa học.

Một ô nguyên tố biểu hiện những gì?
Chu kỳ
– Chu kỳ là một dãy nguyên tố có nguyên tử với số lớp electron giống nhau, được sắp xếp theo thứ tự tăng dần của điện tích hạt nhân.
– Số thứ tự của chu kỳ tương ứng với số lớp electron của các nguyên tử trong chu kỳ đó:
- Chu kỳ nhỏ: bao gồm chu kỳ 1, 2, 3
- Chu kỳ 1 gồm 2 nguyên tố: H và He
- Chu kỳ 2 gồm 8 nguyên tố: Li đến Ne
- Chu kỳ 3 gồm 8 nguyên tố: Na đến Ar
- Chu kỳ lớn: bao gồm chu kỳ 4, 5, 6, 7
- Chu kỳ 4 gồm 18 nguyên tố: K đến Kr
- Chu kỳ 5 gồm 18 nguyên tố: Rb đến Xe
- Chu kỳ 6 gồm 32 nguyên tố: Cs đến Rn
- Chu kỳ 7 gồm 32 nguyên tố: Fr đến Og
Nhóm nguyên tố
– Nhóm nguyên tố bao gồm các nguyên tố có cấu hình electron tương tự, dẫn đến tính chất hóa học gần giống nhau, và được xếp vào cùng một cột.
– Hiện nay, bảng tuần hoàn có 18 cột, được chia thành 8 nhóm A (từ IA đến VIIIA) và 8 nhóm B (từ IB đến VIIIB). Mỗi cột tương ứng với một nhóm, trong đó nhóm VIIIB có 3 cột.
– Các nguyên tử trong cùng một nhóm A có số electron hóa trị giống nhau, tương ứng với số thứ tự của nhóm (trừ heli).
Phân loại nguyên tố
– Theo cấu hình electron
- Các nguyên tố s, p, d, f là những nguyên tố có electron cuối cùng được phân bổ vào các phân lớp s, p, d, f tương ứng.
- Ví dụ: 12Mg:1s22s22p63s2(nguyên tố s)
- Các nhóm A bao gồm nguyên tố s (IA, IIA) và nguyên tố p (từ IIIA đến VIIIA, ngoại trừ He).
- Các nhóm B bao gồm nguyên tố d (từ IB đến VIIIB) và nguyên tố f (bao gồm lanthanides và actinides).
– Dựa trên tính chất hóa học:
- Nhóm IA, IIA, IIIA: bao gồm các nguyên tố s và p là kim loại (ngoại trừ H và B).
- Nhóm VA, VIA, VIIA: chứa các nguyên tố p, chủ yếu là phi kim.
- Nhóm VIIIA: bao gồm các nguyên tố khí hiếm.
- Nhóm B: bao gồm các nguyên tố d và f, đều là kim loại chuyển tiếp.
Bảng tuần hoàn không chỉ đơn thuần là một biểu đồ mà còn là công cụ giúp chúng ta hiểu rõ hơn về các nguyên tố. Khi nắm vững kiến thức về bảng tuần hoàn, các em sẽ có khả năng giải quyết các bài tập hóa học một cách dễ dàng và hiệu quả hơn.
<<Xem thêm>> Nhóm halogen là gì? Halogen gồm những nguyên tố nào?











 Giới thiệu
Giới thiệu Chính sách bảo mật
Chính sách bảo mật Câu hỏi thường gặp
Câu hỏi thường gặp Liên hệ
Liên hệ Kiến thức lớp 10
Kiến thức lớp 10 Cẩm nang học tập
Cẩm nang học tập Định nghĩa
Định nghĩa