Định luật tuần hoàn là một trong những phát hiện quan trọng trong lịch sử hóa học, giúp chúng ta hiểu rõ hơn về sự đa dạng của các nguyên tố. Bài viết sẽ nói đến các khái niệm một cách ngắn gọn và dễ hiểu với các bạn học sinh
Nội dung của định luật tuần hoàn được hiểu như nào?
– Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Ý nghĩa của bảng tuần hoàn các nguyên tố hoá học
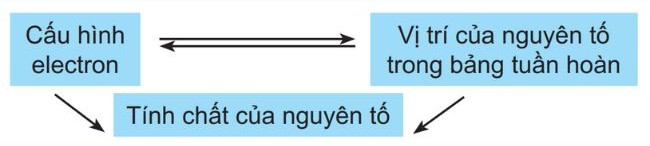
– Vị trí của một nguyên tố trong bảng tuần hoàn hóa học cung cấp thông tin về cấu hình electron của nguyên tử và cấu hình electron này sẽ quyết định tính chất của nguyên tố.
– Vì vậy từ vị trí của nguyên tố trong bảng tuần hoàn hoặc cấu hình electron của nó, chúng ta có thể dự đoán tính chất hóa học của nguyên tố đó.
Bảng luật tuần hoàn
– Ví dụ: Nguyên tố sulfur (S) ở ô thứ 16, nhóm VIA, chu kì 3.
Nguyên tử S có:
+ 16 proton, 16 electron (do số proton = số electron = Z).
+ 3 lớp electron (do số lớp electron bằng số thứ tự chu kì).
+ 6 electron ở lớp ngoài cùng (do số electron ở lớp ngoài cùng bằng số thứ tự nhóm A).
+ Cấu hình electron của S:1s22s22p63s23p4. S là nguyên tố phi kim. Oxide cao nhất (SO3) là acidic oxide và acid tương ứng (H2SO4) là acid mạnh.
– Dựa vào định luật tuần hoàn, có thể so sánh tính chất của một nguyên tố hóa học với các nguyên tố xung quanh.
Ví dụ: So sánh tính phi kim của P (Z = 15) với N (Z = 7) và S (Z = 16):
Nguyên tố P và N cùng nhóm nên N có tính phi kim mạnh hơn P, P và S cùng chu kì nên P có tính phi kim yếu hơn S.
Qua bài viết trên chúng ta đã giải đáp được các khác niệm về định luật tuần hoàn và ý nghĩa của bảng tuần hoàn. Hãy tiếp tục khám phá và tìm hiểu thêm những bài học mới với Kiến thức THPT trong tương lai.
<<Xem thêm>> Bảng tuần hoàn các nguyên tố hóa học lớp 10











 Giới thiệu
Giới thiệu Chính sách bảo mật
Chính sách bảo mật Câu hỏi thường gặp
Câu hỏi thường gặp Liên hệ
Liên hệ Kiến thức lớp 10
Kiến thức lớp 10 Cẩm nang học tập
Cẩm nang học tập Định nghĩa
Định nghĩa