Liên kết cộng hóa trị là gì? Các hợp chất nào có liên kết cộng hóa trị? Mời bạn đọc cùng tìm hiểu thêm về vấn đề này qua bài viết dưới đây của Kiến thức THPT!
Khái niệm thế nào liên kết cộng hóa trị là gì?
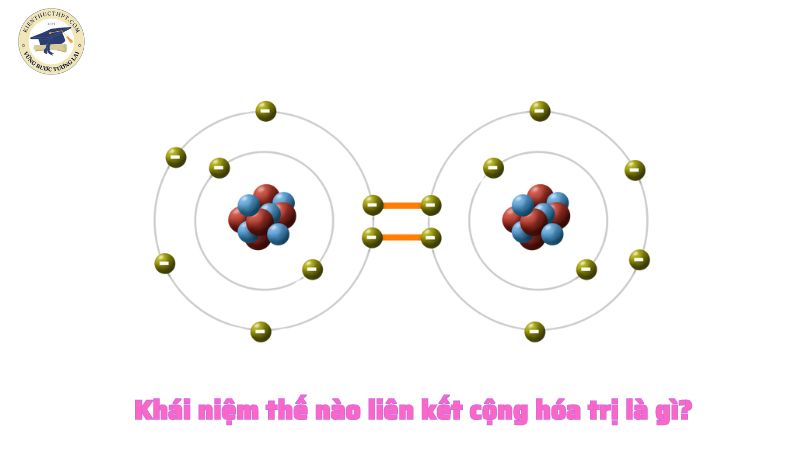
Liên kết cộng hóa trị là gì?
Liên kết cộng hóa trị là loại liên kết xảy ra khi hai nguyên tử liên kết với nhau bằng cách chia sẻ một hoặc nhiều cặp electron.
Nói cách khác, liên kết này xảy ra khi hai nguyên tử hay ion chia sẻ các cặp electron với nhau.
Mỗi cặp electron được chia sẻ giữa hai nguyên tử gọi là cặp liên kết, còn những cặp không được chia sẻ gọi là cặp đơn độc. Trong nhiều phân tử, việc chia sẻ electron giúp các nguyên tử đạt được cấu hình electron bền vững hơn.
Liên kết hóa trị hình thành giữa các số nguyên tử giống nhau – Sự hình thành đơn chất
Sự hình thành của phân tử hidro ( H2 )
Nguyên tử Hidro (Z = 1) có cấu hình electron là 1s^1. Trong đó, hai nguyên tử Hidro liên kết với nhau bằng cách mỗi nguyên tử cung cấp một electron để tạo thành một cặp electron chung.
Như vậy, trong phân tử H2, mỗi nguyên tử Hidro có hai electron, tương đương với cấu hình electron bền vững của khí hiếm heli:
- Công thức electron: H : H
- Công thức cấu tạo: H – H. Giữa hai nguyên tử Hidro có một cặp electron liên kết được biểu thị bằng một gạch nối (-).
- Đây là liên kết đơn.
Sự hình thành phân tử Nito ( N2)
Nguyên tử Nitơ (Z = 7) có cấu hình electron là: 1s^2 2s^2 2p^3, với 5 electron ở lớp vỏ ngoài cùng.
Trong phân tử nitơ N2, mỗi nguyên tử Nitơ đóng góp 3 electron để đạt được cấu hình electron giống như nguyên tử khí hiếm gần nhất là Neon.
Hai nguyên tử N liên kết với nhau thông qua 3 cặp electron. Liên kết này được biểu thị bằng ba gạch (=), là liên kết ba.
Công thức electron: :N (6 chấm) N:
Công thức cấu tạo: N ( 3 gạch) N
Liên kết này rất bền, nên khí nitơ ít hoạt động hóa học ở nhiệt độ thường.
Kết luận:
Từ sự hình thành các phân tử Nitơ và Hidro đã nêu trên, chúng ta có thể rút ra những kết luận về liên kết cộng hóa trị như sau:
- Liên kết trong phân tử Hidro và Nitơ là liên kết cộng hóa trị.
- Liên kết cộng hóa trị là liên kết tạo ra giữa hai nguyên tử thông qua một hoặc nhiều cặp electron chung.
- Mỗi cặp nguyên tử electron chung tạo nên một liên kết cộng hóa trị.
- Các phân tử H2 và N2 được tạo nên từ các nguyên tử cùng một nguyên tố có độ âm điện như nhau, do đó các cặp electron chung không bị kéo lệch về một phía, tạo nên liên kết cộng hóa trị không cực.
>> Xem thêm: Cấu hình electron là gì?
Liên kết giữa các nguyên tử khác nhau – Sự hình thành của hợp chất
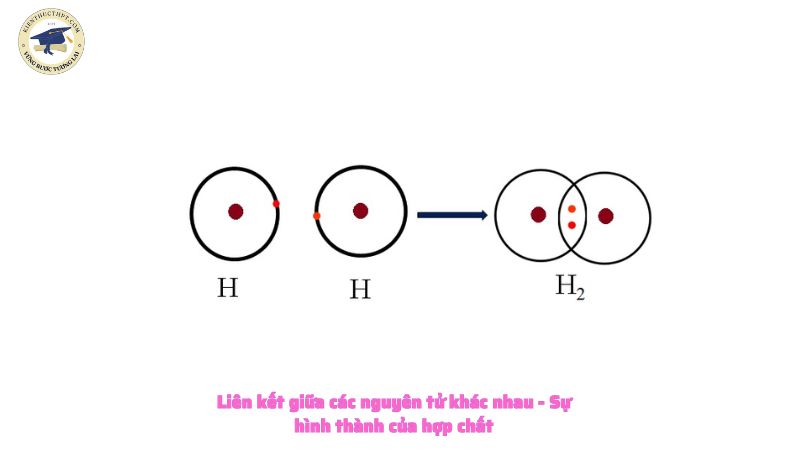
Sự hình thành của hợp chất
Sự hình thành chất hidro clorua ( HCl )
Trong phân tử hidro clorua, mỗi nguyên tử H và Cl đều góp một electron để tạo thành một cặp electron chung.
Độ âm điện của clo là 3,16, cao hơn độ âm điện của hidro là 2,2.
⇒ Cặp electron này bị lệch về phía clo, tạo thành một liên kết cộng hóa trị phân cực.
Kết luận:
Liên kết cộng hóa trị có cực là loại liên kết trong đó cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn. Trong công thức electron của phân tử có cực, cặp electron này được biểu thị lệch về phía kí hiệu của nguyên tử có độ âm điện cao hơn.
Sự hình thành phân tử của khí cacbon dioxit ( CO2 ) ( có cấu tạo thẳng ):
Cấu hình electron của Cacbon (Z = 6) là 1s^2 2s^2 2p^2 với 4 electron ở lớp ngoài cùng.
Cấu hình electron của Oxi (Z = 8) là 1s^2 2s^2 2p^4 với 6 electron ở lớp ngoài cùng.
Trong phân tử khí cacbon đioxit (CO2), nguyên tử Cacbon nằm giữa hai nguyên tử Oxi. Mỗi nguyên tử Oxi và nguyên tử Cacbon góp chung 2 electron với nhau, tạo thành hai liên kết đôi.
Trong quá trình hình thành khí cacbon đioxit (CO2), chúng ta có thể nhận xét như sau:
Theo công thức electron, mỗi nguyên tử Cacbon hay Oxi đều có 8 electron ở lớp ngoài cùng, đạt được cấu hình bền vững giống như khí hiếm. Độ âm điện của Oxi là 3,44 cao hơn độ âm điện của Cacbon là 2,55 ⇒ Cặp electron chung bị lệch về phía Oxi.
Mặc dù liên kết giữa Oxi và Cacbon là phân cực, nhưng do CO2 có cấu trúc thẳng, hai liên kết đôi phân cực (C=O) triệt tiêu lẫn nhau. Kết quả là CO2 là một phân tử không phân cực.
>> Xem thêm: Nguyên tố hóa học là gì? Lý thuyết nguyên tố hóa học lớp 10
Liên kết cộng hóa trị có tất cả mấy loại?
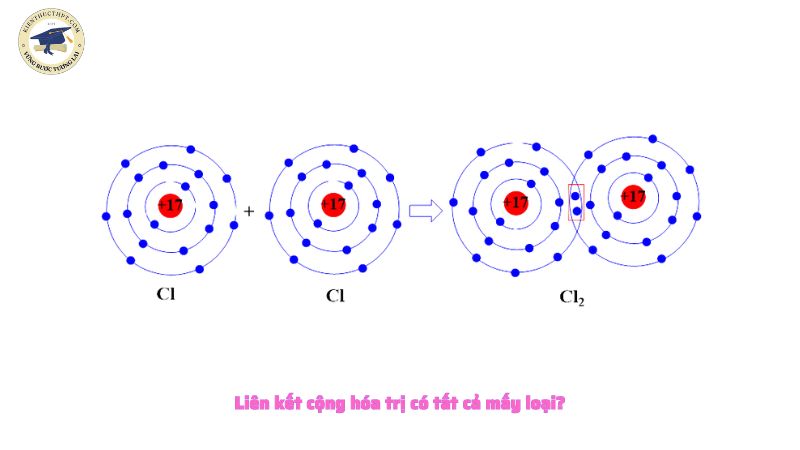
Các loại liên kết cộng hóa trị
Liên kết cộng hóa trị có cực
Liên kết cộng hóa trị phân cực hình thành khi các electron chung giữa các nguyên tử không được chia sẻ đều.
Điều kiện xảy ra: một trong hai nguyên tử có độ âm điện cao hơn nguyên tử kia (do đó có lực hút mạnh hơn). Vì thế, sự chia sẻ electron là không đồng đều.
Đặc điểm: phân tử nghiêng về phía nguyên tử có độ âm điện thấp hơn, còn phía hơi âm thì chứa nguyên tử có độ âm điện cao hơn.
Kết quả: hợp chất cộng hóa trị được tạo thành sẽ mang một điện tích tĩnh điện.
Liên kết hóa trị không cực
Liên kết cộng hóa trị không cực hình thành khi hai nguyên tử chia sẻ các electron một cách đều nhau.
Điều kiện để điều này xảy ra là cả hai nguyên tử phải có lực hút tương đương hoặc độ âm điện gần giống nhau. Khi các giá trị độ âm điện của chúng càng gần nhau, lực hút càng mạnh. Điều này thường gặp ở các phân tử khí diatomic.
Liên kết đơn phân tử
Liên kết đơn xảy ra khi hai nguyên tử chỉ chia sẻ một cặp electron duy nhất. So với liên kết đôi và ba, liên kết đơn yếu hơn và có mật độ electron thấp hơn nhưng lại là liên kết ổn định nhất. Nguyên nhân là do liên kết này có mức độ phản ứng thấp, tức là khả năng mất electron ít bị ảnh hưởng hơn.
Liên kết đôi phân tử
Liên kết đôi xảy ra khi hai nguyên tử chia sẻ hai cặp electron với nhau. Hiện tượng này được thể hiện bằng hai gạch ngang giữa hai nguyên tử trong cùng một phân tử. Liên kết này mạnh hơn liên kết đơn nhưng lại kém ổn định hơn.
Liên kết ba phân tử
Liên kết ba là loại liên kết cộng hóa trị kém ổn định nhất. Loại liên kết này hình thành khi ba cặp electron được chia sẻ giữa hai nguyên tử trong cùng một phân tử.
Tính chất của các hợp chất có liên kết cộng hóa trị là gì
- Dạng tồn tại: các hợp chất chỉ chứa liên kết cộng hóa trị có thể xuất hiện dưới dạng chất rắn (như lưu huỳnh, đường, sắt…), chất lỏng (như rượu, nước…) hoặc chất khí (như clo, khí cacbonic, hidro…). Những chất này thường có điểm nóng chảy và điểm sôi thấp, cùng với enthalpy hóa hơi và nhiệt hạch thấp hơn.
- Đối với các chất có tính phân cực: chẳng hạn như đường và ancol etylic, chúng có khả năng tan tốt trong các dung môi phân cực như nước.
- Đối với các chất không phân cực: ví dụ như ion và lưu huỳnh… chúng có thể tan trong các dung môi không phân cực giống như cacbon tetraclorua, benzen… Các chất chỉ có liên kết cộng hóa trị không phân cực thì không có khả năng dẫn điện ở bất kỳ trạng thái nào.
Trên đây là bài viết của Kiến thức THPT về liên kết cộng hóa trị là gì và một số chất có liên kết cộng hóa trị. Hy vọng bài viết này sẽ hữu ích cho bạn đọc. Xin chân thành cảm ơn.










 Giới thiệu
Giới thiệu Chính sách bảo mật
Chính sách bảo mật Câu hỏi thường gặp
Câu hỏi thường gặp Liên hệ
Liên hệ Kiến thức lớp 10
Kiến thức lớp 10 Cẩm nang học tập
Cẩm nang học tập Định nghĩa
Định nghĩa