Bài viết được tóm tắt toàn bộ nội dung của bài học số 8 giúp các bạn học sinh biết được khái niệm về liên kết hóa học và hiểu rõ hơn về quy tắc octet cũng như xác định được được các chất có liên kết trong phân tử.
Khái niệm về liên kết hóa học
– Liên kết hóa học là sự gắn kết giữa các nguyên tử để hình thành các phân tử hoặc tinh thể ổn định hơn.
– Trong các phản ứng hóa học, chỉ các electron ở lớp ngoài cùng và phân lớp gần lớp ngoài cùng mới tham gia vào việc hình thành liên kết (được gọi là electron hóa trị).
– Electron hóa trị của một nguyên tử thuộc một nguyên tố được biểu diễn bằng các dấu chấm đặt xung quanh ký hiệu của nguyên tố.
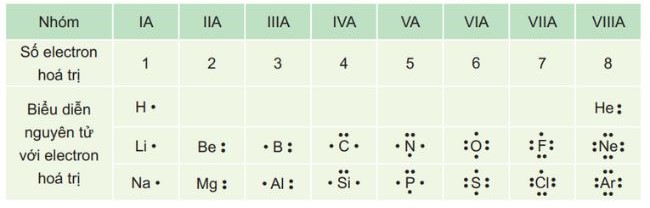
Bảng biểu diễn electron hoá trị của một số nguyên tử
Quy tắc Octet là gì?
– Quy tắc octet (bát tử): Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.Vì các khí hiếm đều có 8 electron lớp ngoài cùng nên quy tắc này gọi là quy tắt octet.
– Ví dụ 1: Vận dụng quy tắc octet trong quá trình hình thành phân tử nitrogen (N2)
- Liên kết giữa 2 nguyên tử nitrogen (N) trong phân tử nitrogen (N2) được tạo thành do mỗi nguyên tử N đã góp chung 3 electron hóa trị, tạo nên 3 cặp electron chung.
- Xung quanh mỗi nguyên tử N đều có 8 electron.
– Ví dụ 2: Vận dụng quy tắc octet trong sự tạo thành phân tử NaF.
- Nguyên tử sodium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron nguyên tử sodium sẽ tạo thành hạt mang điện dương, có cấu hình electron bền vững, giống với khí hiếm gần nhất là Ne.
- Viết gọn: Na→Na++1e−
- Nguyên tử fluorine có 7 electron ở lớp ngoài cùng. Khi nhận vào 1 electron nguyên tử fluorine sẽ tạo thành hạt mang điện âm, có cấu hình electron bền vững giống khí hiếm Ne.
- Viết gọn: F+1e−→F−
- Các hạt tạo thành Na+; F−có điện tích trái dấu hút nhau tạo nên phân tử NaF.
Quy tắc octet là một trong những nền tảng quan trọng để chúng ta hiểu về thế giới vật chất xung quanh. Việc nắm vững quy tắc này sẽ giúp các em giải quyết tốt các bài tập hóa học và chuẩn bị cho những kiến thức nâng cao hơn trong các chương tiếp theo.
<<Xem thêm>> Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn hoá 10 KNTT











 Giới thiệu
Giới thiệu Chính sách bảo mật
Chính sách bảo mật Câu hỏi thường gặp
Câu hỏi thường gặp Liên hệ
Liên hệ Kiến thức lớp 10
Kiến thức lớp 10 Cẩm nang học tập
Cẩm nang học tập Định nghĩa
Định nghĩa